蛋白質組質譜新方法一覽
2003年人類基因組精細圖繪制完成,是人類科學史上一個里程碑式的事件。后基因組時代的研究重點自然落在了蛋白質頭上。為啥?因為中心法則告訴我們,基因的產物——蛋白質,是生命活動的最終執行者。與基因組類比,研究生物體內全套蛋白質的科學,就是蛋白質組學。基因組計劃完成的同年,人類蛋白質組計劃啟動,令人激動的是,2014年人類蛋白質組的草圖也完成了。而蛋白質組學能夠飛速發展的最大功臣非質譜莫屬。質譜的應用范圍非常廣泛,但這里只討論蛋白質組學中的質譜。
簡單地說,質譜法(mass spectrometry)就是對肽段離子的重量(質荷比,m/z)進行測量的分析方法。樣品經質譜儀(mass spectrometer)檢測得到質譜圖(mass spectrum),通過對質譜圖的分析就可以對樣品中的蛋白進行鑒定、定量。親,圖1的這種典型的蛋白質組學流程都很熟悉吧。蛋白首先都要被特異性的酶(通常為Trypsin)切割為肽段,再進行后續分析,這在蛋白質組學中被稱為“自下而上”的研究策略(Bottom-up proteomics)。我們平時見到的質譜分析基本都是這種類型。提到蛋白質組,即會聯想到一系列高大上的名詞,iTRAQ、SWATH、SILAC、Shotgun、Label-free等等。很多概念容易弄混淆,下面我們就來理理清楚。
??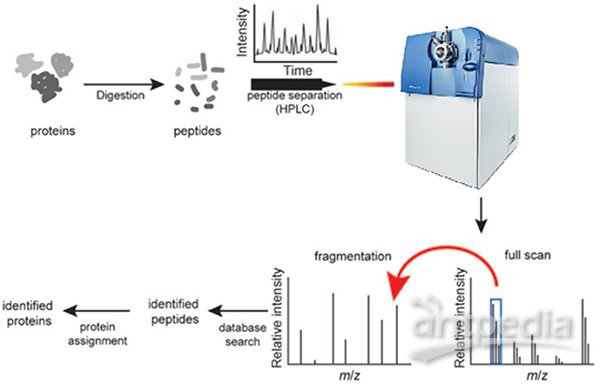
圖1. 典型的蛋白質組學流程
大體上,質譜研究蛋白主要是鑒定和定量。通過二級質譜圖(MS2或者MS/MS)進行數據庫搜索匹配鑒定蛋白。通過各種標記或非標記的手段對不同樣品中的蛋白進行比較就是定量。蛋白定量比較是質譜最重要的用途,圖2是對定量方法的一個簡單總結。
非標定量(Label-free)不需要標記,不同樣品分別處理、分別進質譜檢測;優點是處理簡單、無需標記、價格便宜、可以比較很多組樣品,缺點是對操作步驟、LC、質譜穩定性要求嚴格。
蛋白質非標記定量技術(label-free)是通過液質聯用技術對蛋白質酶解肽段進行質譜分析,無需使用昂貴的穩定同位素標簽做內部標準,只需分析大規模鑒定蛋白質時所產生的質譜數據,比較不同樣品中相應肽段的信號強度,從而對肽段對應的蛋白質進行相對定量。特點:(1)無需昂貴的同位素標簽做內部標準,實驗耗費低;(2)對樣本的操作少,從而使其最接近原始狀態;(3)不受樣品條件的限制,克服標記定量技術在對多個樣本進行分析方面的缺陷;(4)對實驗操作穩定性、重復性要求高,要求至少做三次生物重復。
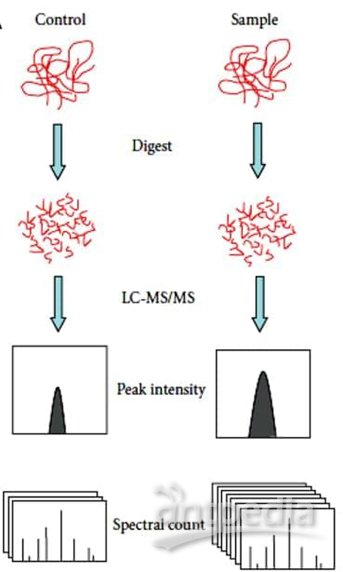
Lable Free定量(LFQ)
SILAC是在細胞培養基中加入穩定同位素標記的氨基酸,在代謝水平標記蛋白,一級質譜圖進行定量,可以做到三組樣品混合后進行比較,定量準確,但是不能標記組織樣本,養細胞成本也較貴。
SILAC即細胞培養條件下穩定同位素標記技術(Stable Isotope Labeling By Amino Acids In Cell Culture,SILAC),其實驗原理是:
?在細胞培養基中加入輕、中或重型穩定同位素標記的必需氨基酸(賴氨酸和精氨酸),通過細胞的正常代謝,使新合成的蛋白帶上穩定同位素標簽。?
?等量混合各類型蛋白質,酶解后進行質譜分析。?
?通過比較一級質譜圖中同位素峰型的面積大小進行相對定量,?
?同時二級譜圖對肽段進行序列測定從而進行蛋白鑒定。
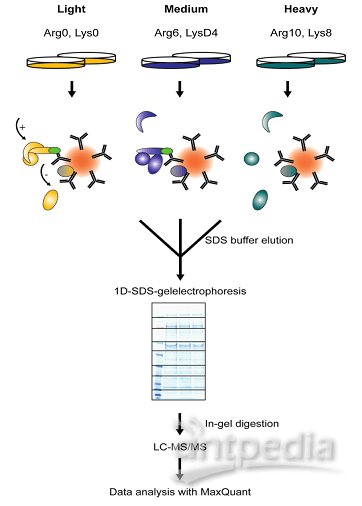
SILAC
雙甲基化標記是通過化學反應的辦法在肽段水平進行標記,一級質譜定量,也可以三組對比,標記試劑都比較便宜,而且可以標記任何來源的樣品。其特征在于:利用作用位點為賴氨酸羧基的蛋白酶將蛋白質酶切成肽段,根據肽段的N末端氨基和C末端賴氨酸側鏈氨基在pH酸性條件下反應速度不同的性質,依次在酸性、堿性條件下對肽段N末端和C末端進行二甲基化標記;通過二甲基化標記試劑甲醛CH2O、氰基硼氫化鈉NaBH3CN及其相應同位素13CH2O、CD2O、13CD2O、NaBD3CN的組合實現兩重至六重中一種或二種以上的標記,使肽段每端的標記有所不同,而肽段的總質荷比相同,從而使肽段在液質聯用的質譜儀中得到的一級譜具有相同的質荷比,而二級譜每種碎片離子都存在質荷比差異,利用二級譜碎片離子強度進行蛋白質的多重定量分析。
按照權利要求1所述的定量方法,其特征在于:所述依次在酸性、堿性條件下對肽段N末端和C末端進行二甲基化標記,并通過二甲基化標記試劑甲醛、氰基硼氫化鈉及其相應同位素的組合實現六重標記,六重標記試劑為:
肽段N末端:13CH2O+NaBH3CN——肽段C末端:CD2O+NaBD3CN;
肽段N末端:CD2O+NaBH3CN——肽段C末端:13CH2O+NaBD3CN;
肽段N末端:13CD2O+NaBH3CN——肽段C末端:CH2O+NaBD3CN;
肽段N末端:CH2O+NaBD3CN——肽段C末端:13CD2O+NaBH3CN;
肽段N末端:13CH2O+NaBD3CN——肽段C末端:CD2O+NaBH3CN;
肽段N末端:CD2O+NaBD3CN——肽段C末端:13CH2O+NaBH3CN。
雙甲基化標記定量
iTRAQ和TMT是商品化的試劑盒,肽段水平標記,二級質譜定量;分別可以做到最多8組和10組樣品間蛋白質組的比較。
以iTRAQ為例(TMT和iTRAQ類似),iTRAQ是一種同位素標記試劑,可與氨基連接的胺標記同重元素。兩種:4-plex和8-plex,可同時標記4組或8組樣品。
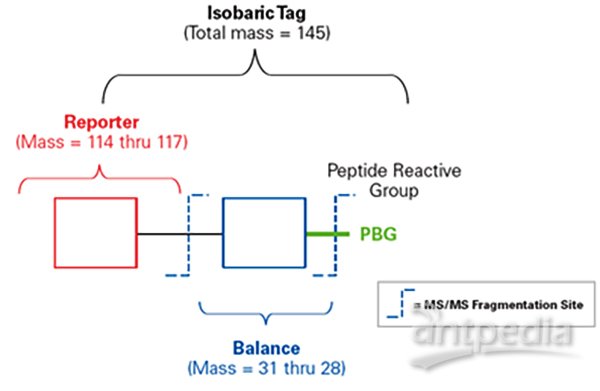
?iTRAQ包括三部分:報告基團(reporter group ),平衡基團(balance group),肽反應基團(peptide reactive group)。?
?報告基團(reporter group):質量分別為114Da、115Da、116Da、117Da。?
?平衡基團(balance group):質量分別為31Da、30Da、29Da、28Da,使得四種iTRAQ試劑報告基團和平衡分子的總分子量均為145Da,無論使用哪種iTRAQ試劑,不同同位素標記同一肽段后在一級質譜中,分子量完全相同,呈現的都是同一峰值。?
?肽反應基團(peptide reactive group):將reporter group與肽N端及賴氨酸側鏈連接,從而將報告基團和平衡基團標記到肽段上,幾乎可以標記樣本中所有蛋白質。?
?8-plex的報告基團共有八種,質量分數分別為114-121Da,因此iTRAQ最多可同時標記8組樣品。
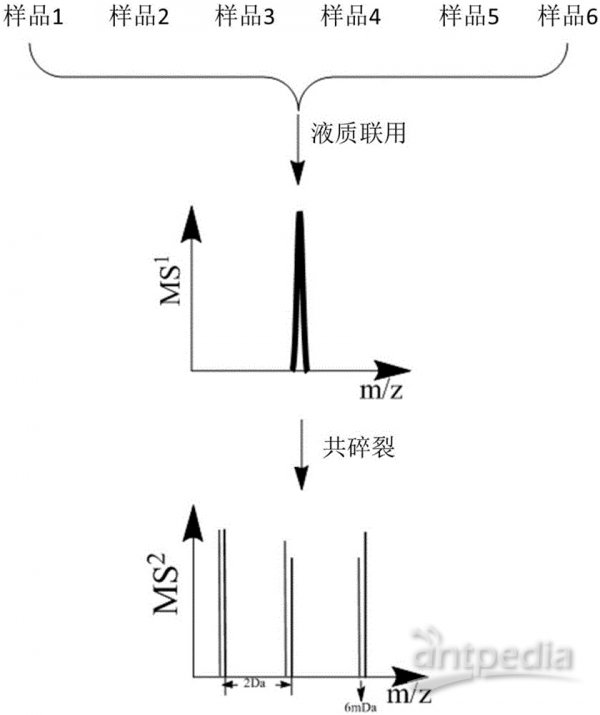
分別標記各酶解后的樣品,混合,一級質譜全一樣,二級質譜各報告離子分開,對各二級質譜定量,即可知在各樣品中的相對含量,即相對定量。
4-plex為例說明iTRAQ試劑標記原理
iTRAQ標記后,一級質譜全一樣
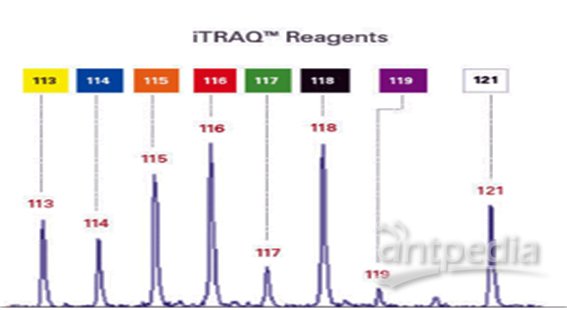
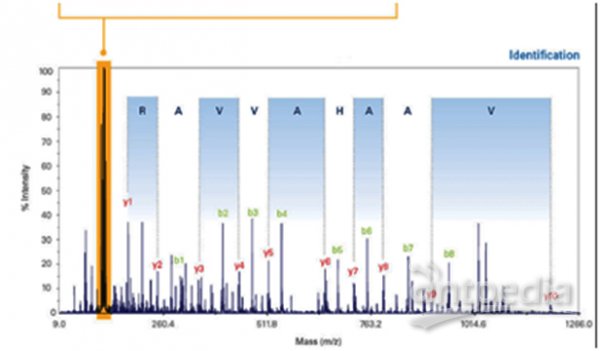
iTRAQ:利用二級質譜報告離子定量
?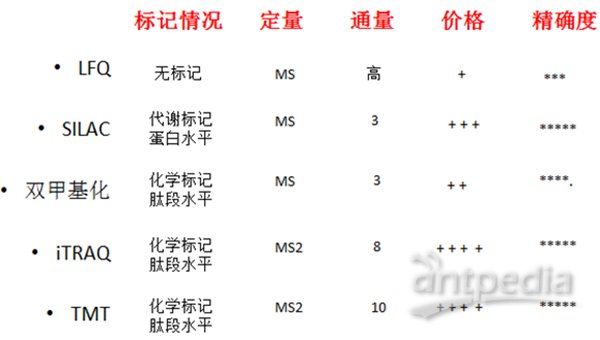
圖2. 質譜定量方法
? 以上這幾個是一家的,還有幾個名詞是屬于另外一家,比如Shotgun (DDA)、SWATH/DIA、SRM (MRM)、MRMHR/PRM。質譜進行數據采集的方式大致分為三種:鳥槍法(Shotgun)、選擇反應監控(SRM)和全景式的SWATH/DIA。下面對照圖3再來簡單介紹一下。
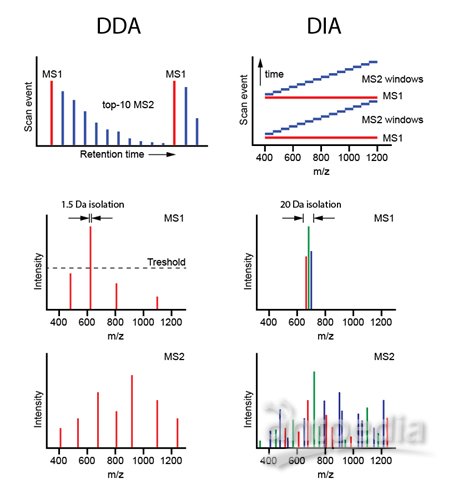
DDA(shotgun)和SWATH/DIA的區別
?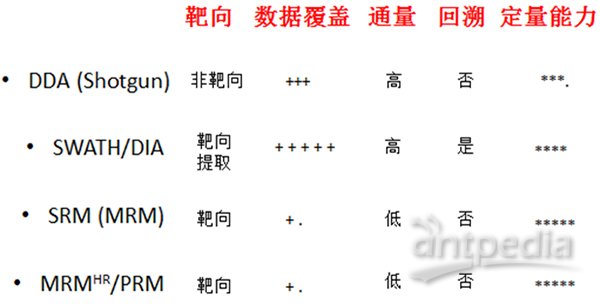
圖3. 質譜掃描方式
DDA、IDA、Shotgun和鳥槍法說的是相同的東西,意思是質譜在每個循環的中從一級里挑選豐度高的TopN個肽段去打碎做二級掃描,得到的結果通過與已知數據庫中的理論蛋白進行匹配。DDA簡單有效,分析流程比較成熟,也是目前質譜分析的主流方式。DDA也有其固有的缺陷,即具有一定的隨機性,偏向于檢測豐度較高的肽段,而抑制了低豐度肽段的檢測。
靶向策略被稱為質譜領域的Western blot。質譜只去采集目標肽段大小的離子信息,因而提高了靈敏度和特異性。這種方法用來研究感興趣的特定蛋白,定量準確,但是通量很有限。
SWATH/DIA這種全景式的數據采集方式在最近幾年突然火了起來,被認為在不遠的未來可能會取代DDA的主流位置。該方法采取的策略是將掃描范圍內的所有肽段按照質荷比分為若干個窗口,再對每個窗口里所有的肽段一起打碎,采二級,數據分析時通過抽提蛋白的子離子信息進行定量。SWATH/DIA解決了DDA中隨機性選擇肽段的缺陷,所以重復性更好,定量的準確性基本達到了SRM的水平,而且可以實現大規模定量。
借用聽來的一個比喻來說明:DDA就像機關槍掃射,數量多、體積大的目標命中的概率要大一些。靶向掃描(SRM或PRM)就像精準狙擊,排除干擾,目標明確,每一槍直指目標,但是難以大規模消滅敵人。SWATH/DIA就是地毯式轟炸,只要暴露在我方攻擊范圍內的敵人,不管三七二十一,全部炸完。
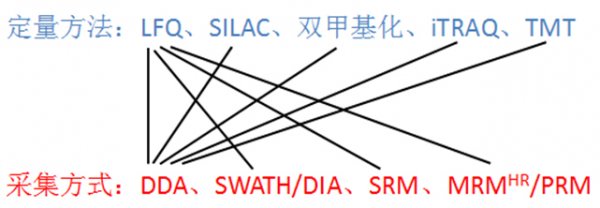
?圖4. 定量方法與采集方式結合
如果將上述的定量方法(圖2)和質譜數據采集方式(圖3)結合起來,就得到了現在基于質譜的蛋白質組學研究的各種策略(圖4)。再打個比方,保證吃貨們一聽就懂:雞、魚、肉、蛋、蔬菜要通過炒鍋、烤箱、高壓鍋、微波爐等烹調之后才能變為美食,填飽肚子。同樣的,各種定量方法(非標的和標記的)處理的樣品,要通過質譜各種采集方式變為電腦中的數據,才能分析并從中得到蛋白的信息。
?
References
1.A draft map of the human proteome. Nature 509: 575–581 (2014)
2.Mass-spectrometry-based draft of the human proteome. Nature 509: 582–587 (2014)
3.A review: Annu. Rev. Biochem. 80: 273–99 (2011)
4.SILAC: Molecular & Cellular Proteomics 1: 376-386 (2002)
5.iTRAQ: Molecular & Cellular Proteomics 343: 91–99 (2010)
6.SRM: Nature Methods 9: 555–566 (2012)
7.SWATH: Molecular & Cellular Proteomics 11: 1–17 (2012)
-
招標采購

-
標準

-
招標采購

-
精英視角

-
焦點事件
-
企業風采

-
企業風采
-
焦點事件

-
焦點事件